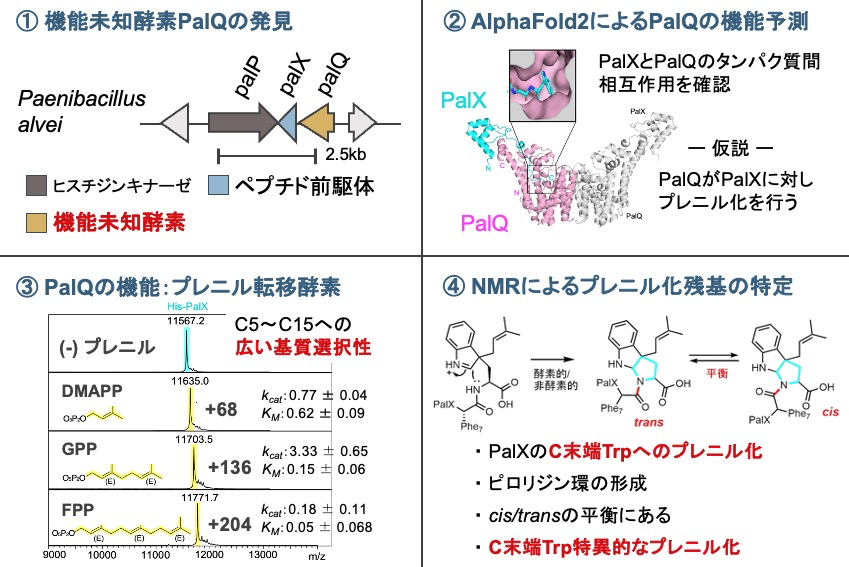
タンパク質の多くは、翻訳後修飾を受けることにより生理的機能を発現します。翻訳後プレニル修飾は、真核生物の一次代謝産物や細菌の二次代謝産物に見られ、生体分子の相互作用において重要な役割を果たします。それぞれの生物において、多様なプレニル転移酵素がプレニル修飾を行っています。
本研究において、従来のゲノムマイニングのアプローチに、AlphaFold2によるタンパク質相互作用予測を組み合わせ、新規なプレニル基転移酵素PalQを発見しました。PalQは、様々な鎖長 (C5〜15) のプレニル基を転移でき、そのプレニル基は、PalXのC末端にあるTrpの側鎖Cg位に対し、順方向で結合させます。プレニル化後、生成物は酵素的または非酵素的に、三環式ピロロインドール構造を形成します。また、ペプチド骨格にシス/トランス異性化を与えることも明らかとなりました。本プレニル化はペプチド産物に構造多様性を与えるだけでなく、その運動性も変化させることが示唆されました。PalQは、真核生物のプレニル転移酵素と同様に、C末端残基のみをプレニル化しますが、細菌のプレニル基転移酵素としては初めての発見でした。PalQの広いプレニル基質選択性は、ペプチド医薬品開発に向けた脂質化ツールとして期待されます。(修士2年 宮田 梓)
Structure Prediction and Genome Mining-Aided Discovery of the Bacterial C-Terminal Tryptophan Prenyltransferase PalQ (リンク)
Azusa Miyata, Sohei Ito, Daisuke Fujinami, ADVANCED SCIENCE, 07 December 2023,